生命科学学院李继喜课题组发现程序性细胞坏死新型“刹车”分子
生命科学学院教授李继喜团队在程序性细胞坏死研究领域取得重要进展,发现和鉴定了靶向坏死关键蛋白RIP3的新型“刹车”分子TRIM25。5月5日,研〖究论文以《E3连接酶TRIM25泛素化修饰RIP3从而抑制肿瘤坏死因子TNF引起的细胞坏死》(“E3 ligase TRIM25 ubiquitinates RIP3 to inhibit TNF induced cell necrosis”)为题发表在※《细胞死亡与分化》(Cell Death and Differentiation)杂志上。
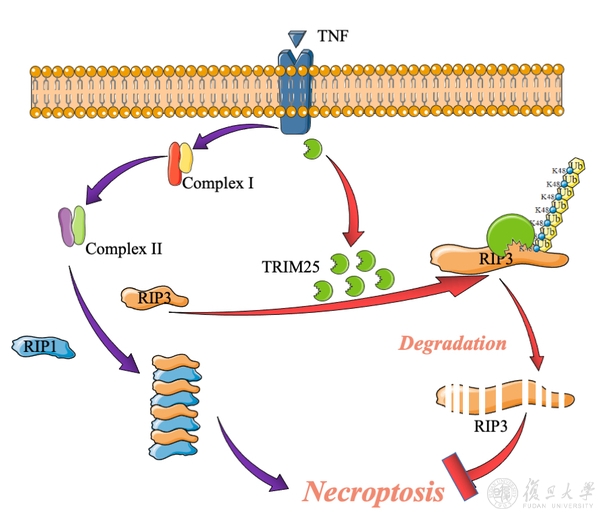
TRIM25介导RIP3的泛素化修饰从而负调控TNF诱导的程序性细胞坏死
程序性细胞坏死与肿瘤发生发展、免疫及代谢性疾⊙病相关,在出血性脑卒中及肝损伤、心肌出血性坏死、神经退行性疾①病以及高雪氏病中起着十分重要的作用。程序性细胞坏死可以由多种因素诱导产生,如死亡受体、Toll样受体、胞质内RNA或DNA感知蛋白ZBP1等;而TNF信号引起的细胞坏死主要由坏死小体(necrosome)蛋白RIP1、RIP3和MLKL介导。李继喜课题♂组长期从事程序性细胞坏死的结构基础与调控机制研究,早期发现RIP1/RIP3介导的坏死小体形成功能性的β淀粉样纤维复合物,作为级联放大平台,激活程序性细胞坏死(2012,Cell);通过结构生物学方法和手段解析了坏死小体的高分辨率三维结构(2018,Cell);发现介导RIP1/RIP3相互作用的RHIM结构域可以跨物种发挥功能,在昆虫固有免疫应答IMD信号通路中激活NF-kB,产生多种々抗菌肽(2017,Immunity)。
在本研究中,李继喜团队通过高灵敏质谱方法筛选并鉴定到RIP3的特异性E3泛素连接酶TRIM25。TRIM25与RIP3在体外和体内发生■直接相互作用;敲除或者敲低TRIM25基因后细胞死亡显著增强;TRIM25通过K48修饰的多聚泛素化特异性作用于人源RIP3基因的K501氨基酸,进一步□通过蛋白酶体途径降解RIP3从而抑制TNF诱导的程序性细胞坏死。这项研究揭示了RIP3的翻译后修饰调控细胞坏死的全新机制,将为开发与细胞坏☆死相关的药物提供新的□ 作用靶标和治疗方法奠定基础。
复旦大学博士研究生梅谱成和谢飞艳为论文共同第一作者,李继喜为论文通讯→作者。生命科学学院教授丁琛、吴家雪、王永明以及附属华山医院教授陈向军给予了支持和帮助。
论文链接:https://www.nature.com/articles/s41418-021-00790-3
未经允许不得转载:二九年华大学门户 » 生命科学学院李继喜课题组发现程序性细胞坏死新型“刹车”分子
相关推荐
- 历史▓地理研究中心成立20周年暨《历史地理研究》发刊研讨会举行
- 现代物理研究所教工党支部举行学习∮总书记重要回信精神主题党日活动
- 复旦大学举行疫情防控应急处置演练
- 复旦大学2018年“一二·九”主题歌会唱响青春
- 复旦大学党委书记焦扬为全校团员上五四主题ㄨ团课
- 第三届“上海医改十大创新举措”出炉 复旦上医2个项目入选,1个项目荣获提名奖
- 周谷城先生Ψ诞辰120周年座◥谈会暨《周谷城全集》首发式在复旦大学举行
- 共和国ぷ不会忘记!清明前夕,革命烈士精神进复旦校园
- 复旦大学一带╳一路及全球治理研究院国际咨询委员会第二次会议召开
- 公共卫生学院获批教育部、卫健委“高层次应用型公共卫生人才培养创∩新项目”
- 复旦大学教授刘钊著《古文字构形学》获第四届全球华人国学成果奖
- 复旦大学2020年上海市综合评价录取改革试点选拔结果正式公布
- 工程与应用技术研究院教工党支部开展主题党日活动
- 复旦专家推出HER2阳性乳癌▽治疗“亚洲标准” “双靶”方案使HER2阳性乳腺①癌新辅助治疗疗效翻番
- 首届全国高校教师教学创新大赛全国赛︻研讨会暨省(区、市)赛总结会在复旦大学举行
- 中国大陆∑首个!复旦大学国际灾害风险综合研究计划国际卓越中心启动
- 郜元宝:历史从不曾像今天这样亟须“打捞”
- 沉痛悼念复旦大学首席教授邹逸麟先生
- 第十届反应堆物理与核材料学术研讨会在沪举行
- 上海生物医学检测试剂工程技▂术研究中心︾揭牌
新闻公告
- 复旦-华为集成电路科研人才合作揭牌暨启动仪式举行 05-21
- 闻玉梅、李圣青为复旦上医师生开讲党课 05-21
- “复旦大学-中学学术实践基地项目”将启动 05-20
- 2021书院传统文化月迎来“风雅集市” 05-20
- 复旦大学加入“北极大学联盟” 05-17
- 复旦剧社原创话剧《种子天堂》在相辉堂第三度上演 05-16
- 第十届反应堆物理与核材料学术研讨会在沪举行 05-14
高考招生
- 复旦大学2017年招╲生章程 08-05
- 复旦大学2018年招生▅章程 08-05
- 复旦大学2014年招生〗章程∞ 08-05
- 复旦大学2015年招生章程 08-05
- 复旦大学2016年招生章程 08-05
- 复旦大学2012招生章程 08-05
- 复旦大学2013年招生章程 08-05
- 复旦大学2008年招生章程 08-05
- 复旦大学2009年招生章程 08-05
- 复旦大学2011年招生章程 08-05
