河南大学以通讯单位在Cell发表■研究论文揭示叶绿体蛋白转运新机制
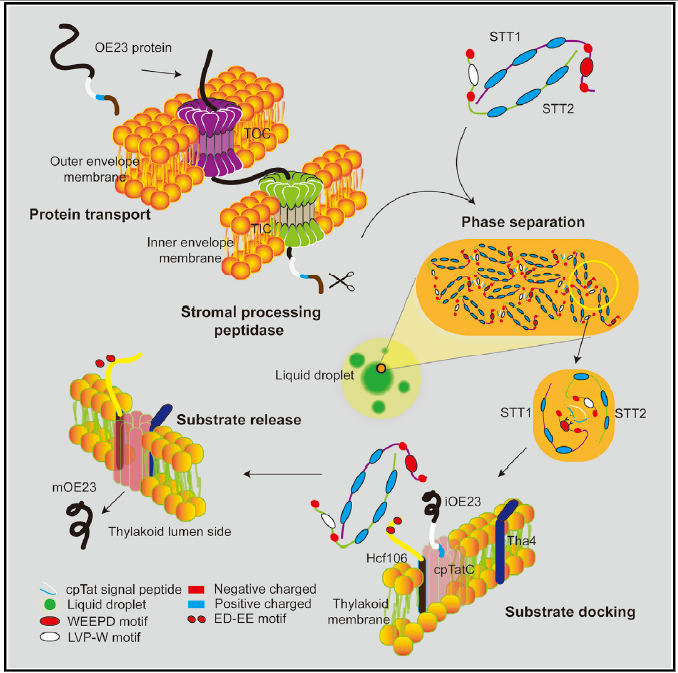
STTs介导的相分离驱动叶绿体内蛋白分选机制
2020年3月12日,河南大学生命科学学院/作物逆境适应与改良国家重点实验室张☆立新教授课题组及合作者在光合作用研究领域取得重要进展,在国际上首次提出并阐明了相分离驱动叶绿体内蛋白分选的新机制,推动了蛋白转运机理的进一步深入,揭示了相分离的重要生理意义,而且对于探讨叶绿体的生物发生、光合器官的建成和功能调节以及真核生物的起源和进化等都具有重要的意义。该研究成果以“Liquid-liquid phase transition drives intra-chloroplast cargo sorting”为题,以全文形式在《Cell》杂志在线发表(DOI: 10.1016/j.cell.2020.02.045)。张立新教授为本文▆通讯作者,中国科学院植物研究所是第一作者单位,河南大学是通讯作者单位。
光合作用是地球上最大规模地利用太阳能,把二氧化碳和水合ㄨ成为有机物,并放出氧气的过程。叶绿体是植物光合作用场所。叶绿体是由光合细菌共生演变而来的,在光合作用№及其他多种重要生理过程中发挥着关键性的作用。叶绿体具有半自主性,95%叶绿体蛋白是由核基因编码的,在胞质中合成为≡前体后,通过叶绿→体外被膜和内被膜上的转运通道将蛋白质转入叶绿体的不同区域才能使叶绿体行使光合功能。然而一直以来科学家们对于核¤编码叶绿体蛋白在跨过叶绿体被膜之后如何被分选、穿过拥挤的基质空间、并精确地靶定到特异性类囊体膜复合物的分子机制々依然不清楚。
该研究发现了位于叶绿体基质的关键蛋白转运分选因╳子STT1与STT2,阐明了双精氨酸依赖转运途径的底物识别、分选以及转运靶定到双精氨酸依赖转运途径的分子机制。STT1与STT2蛋白都包含N端的IDR (intrinsically disordered region) 结构域与C端的ankyrin repeat结构域。STT1与STT2能够⊙依赖于ankyrin repeat结构域的相互作用形成一个椭圆球状异源二聚体结构,而STT1与STT2的IDR区域分别含有保守的WEEPD基序与LVP-W基序,负责识别底物信号肽的双精氨酸(RR)基序←与疏水结构域(H domain)。研究表明底物结合后会激活STT复合物进一步组装相分离形成浓缩的液滴。STT-底物相分离液滴协助底物】穿过叶绿体基质从而靶定到类囊体膜。而Hcf106能够抑制STT的相分离从而释放底物,完成底物的正确运输与装配。这种方∑式可能既能确保底物折叠,同时保持底物信↓号肽的活性便于被下游Tatc/Hcf106通道识别。阻碍STT-Hcf106结合会阻断Tat底物的运输,影响植物光合〗作用从而导致植物致死的表型。该研究首次发现了相分离调控叶绿体蛋白转运,从而调控叶绿体生成和光合作用。该研究揭示了调节细胞器生物发生蛋白@ 转运相分离的保守机制,为研究细胞如何精确调控生理过程拓展了々新思路。
该研究工作受到国家自然科学基金委、科技部、河南大学等项目的资助。
未经允许不得转载:二九年华大学门户 » 河南大学以通讯单位在Cell发表研究论文揭示叶绿体蛋白转运新机制
- 上一篇:张宝明调研指导疫情防控工作
- 下一篇:开封市副市长黄玉国来校调研
相关推荐
- 外语学院召开新冠肺炎疫情防控工作视♂频会议
- 数学与统计学▲院举办2020年大学生数学冬令营
- 临床医学院举办急救知识宣讲活▓动
- 北京校友会举行2019年迎新联谊会
- 第三届两宋论坛举行
- “路费补助”情暖学子归乡路
- 文学院学生开展@“疫情防控”主题团日活动
- 马远方团队新冠病毒检测试剂盒科研成果成功转化
- 我校师生热议全省教育大会重要精神
- 我校举行“我为河南大学建言”征文比赛颁奖典礼
- 教育科学学院举行2020年教职工新春联欢会
- 生命科学学院召开多次疫情防控工作会议
- 临床医学院举行学业规划指导报告会
- 携手并肩二十载 风雨同舟战疫情——河南大学为阿克伦大学捐赠的防疫物资今日寄出
- 淮河医院成立65周年线∮上庆典活动举行
- 一次特别的AK论坛
- 土木建筑学院走访慰问离退休教师
- 我校召开B+类学科建设工作推进会
- 众志成城,共克时艰,坚决打赢疫情防控阻击战 ——环境与▃规划学院研究生四个党支部齐发力
- 开封市委书记侯红、市长高建军一行来校调研
新闻公告
- 河南日报:追寻河南大学医学的百年传奇 04-17
- 临床医学院组织师生在线观影活动 04-16
- 土木建筑学院举行2020年首场博士招聘视频面试 04-16
- 药学院举行博士招聘网络面试 04-16
- 武术学院召开2020年研究生复试工作会议 04-16
- 濮阳市科技局、联众兴业化工来校交流 04-16
- 中胞生物医疗集团向河南大学捐赠一次性使用医用口罩 04-16
高考招生
- 河南大学2018年招△生章程 08-05
- 河南大学2018年本科招生主要政策 08-05
- 河南大学2017年普通本科招生章程↙ 08-05
- 河南大学2016年普通本科招生章程 08-05
- 河南大学2017年普通本科招生章程 08-05
- 河南大学2014年招生章程 08-05
- 河南大学2015年普通本科招生章程 08-05
- 河南大学2012年招生章程 08-05
- 河南大学2013年招生章程 08-05
- 河南大学2010年招生章程 08-05
